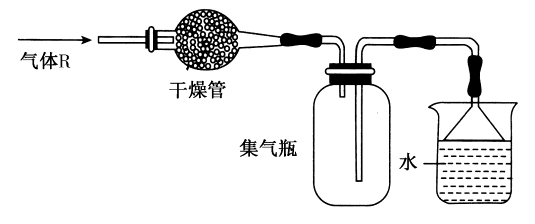
在黑龍江省哈爾濱市第三中學(xué)校2018-2019學(xué)年高一10月月考化學(xué)試題中,氣體相關(guān)知識是重要考查內(nèi)容之一。氣體作為物質(zhì)的一種基本狀態(tài),其性質(zhì)、定律和應(yīng)用貫穿于高中化學(xué)學(xué)習(xí)的始終。本文將以該月考試題為切入點(diǎn),解析氣體相關(guān)的重要知識點(diǎn)。
氣體具有可壓縮性和擴(kuò)散性,這是由其分子間距離較大、分子作用力較弱決定的。在標(biāo)準(zhǔn)狀況下(0℃,101kPa),1mol任何氣體所占的體積都約為22.4L,這一規(guī)律被稱為氣體摩爾體積,是進(jìn)行氣體體積與物質(zhì)的量換算的基礎(chǔ)。
理想氣體狀態(tài)方程PV=nRT揭示了氣體的壓強(qiáng)(P)、體積(V)、物質(zhì)的量(n)和溫度(T)之間的定量關(guān)系,其中R為比例常數(shù)。該方程是解決氣體相關(guān)計算問題的核心工具。與之相關(guān)的還有玻意耳定律(溫度恒定時,壓強(qiáng)與體積成反比)、查理定律(體積恒定時,壓強(qiáng)與熱力學(xué)溫度成正比)等經(jīng)驗定律。
在實際應(yīng)用中,我們還需要注意:
- 氣體摩爾體積只適用于氣體,固體和液體不遵循此規(guī)律。
- 涉及氣體體積的計算時,必須注意是否處于相同溫度和壓強(qiáng)下,否則需進(jìn)行換算。
- 阿伏伽德羅定律指出:在同溫同壓下,相同體積的任何氣體都含有相同數(shù)目的分子。
通過哈三中月考試題的訓(xùn)練,學(xué)生應(yīng)掌握氣體體積的簡單計算、氣體定律的應(yīng)用以及相關(guān)實驗的基本操作。理解這些基礎(chǔ)知識,將為后續(xù)學(xué)習(xí)化學(xué)反應(yīng)中的氣體問題、化學(xué)平衡等打下堅實基礎(chǔ)。
氣體知識雖基礎(chǔ)卻至關(guān)重要,需要同學(xué)們在理解概念的基礎(chǔ)上,通過練習(xí)熟練掌握其應(yīng)用。